Наукові публікації MedPark

1Department of Prosthodontics, Dental Research Institute, Dental and Life Sciences Institute, Education and Research Team for Life Science on Dentistry, School of Dentistry, Pusan National University, Yangsan-si 50612, Корея; joonetak@hanmail.net (W.-T.C.); hsh2942@hanmail.net (S.-H.H.); cmjeong@pusan.ac.kr (C.-M.J.) 2 Department of Prosthodontics, Biomedical Research Institute, Pusan National University Hospital, Бусан 49241, Корея; soyeunkim179@gmail.com 3 Advanced Radiation Technology Institute, Korea Atomic Energy Research Institute, 29 Geumgu-gil, Jeongeup-si 56212, Корея; sijeong@kaeri.re.kr 4 Department of Veterinary Surgery and R&BD Center, College of Veterinary Medicine, Chonnam National University, Gwangju 61186, Корея; vetkang@chonnam.ac.kr (S.-S.K.); ksevet@chonnam.ac.kr (S.-E.K.) *Для кореспонденції: huhjb@pusan.ac.kr; Tел.: +82-10-8007-9099; Fax: +82-55-360-5134 † Зазначені автори зробили рівний внесок у цю статтю.
S.-I.; Kang, S.-S.; Kim, S.-E.; Hwang,
S.-H.; Jeong, C.-M.; Huh, J.-B. Вплив індукованого
гамма-випромінювання на остеоінтеграцію та
регенерацію кісткової тканини. Матеріал 2021, 14, 3268.
Науковий редактор: Paolo Cappare
Прийнято: 28 квітня 2021 р.
Прийнято до розгляду 10 червня 2021 р.
Опублікована: 13 червня 2021 р.
Примітка видавця: MDPI зберігає нейтралітет
щодо юрисдикційних претензій у
опублікованих карт та інституційної приналежності
Посилання:Авторське право: © 2021, автори. Ліцензіат MDPI, Базель, Швейцарія. Ця стаття є статтею з відкритим доступом і поширюється відповідно до умов ліцензії Creative Commons Attribution (CC BY)
Взаємодія між кісткою і поверхнею імплантату є ключовим фактором остеоінтеграції. Для поліпшення цього процесу були розроблені різні методи модифікації поверхонь титанових імплантатів [1-3]. Модифікації титанових поверхонь впливають на регенерацію кістки та біосумісність, а також сприяють успішній фіксації імплантату без втручання в м'які тканини [4-6].
Відомо, що збільшення шорсткості поверхні та покриття імплантатів біосумісними матеріалами або факторами росту сприяють остеоінтеграції титанових імплантатів [7]. Зокрема, колаген I типу використовують як біосумісний полімер, оскільки він сприяє диференціюванню остеобластів і забезпечує відповідне середовище для формування кістки [8-10].
На молекулярному рівні колаген I типу має заплутану триспіральну структуру з двома α1 (I) і одним α2 (I) поліпептидними ланцюгами, і багаторічне клінічне дослідження довело, що він є біосумісним, біоактивним і біорезорбованим матеріалом [11,12]. Поверхні імплантатів, покриті колагеном I типу, створюють сприятливе середовище для початкової адгезії остеобластів і стимулюють їхню проліферацію [9].
Однак швидке поглинання і розщеплення ферментами, а також імунні реакції на колаген тваринного походження призводять до деструкції колагену I типу, тому для підвищення його стабільності in vivo потрібен крослінкінг [13]. Глутаральдегід (ГА) широко використовується як крослінкер для біоматеріалів на основі колагену, а крослінкінг колагену ГА знижує його антигенність, робить його стійким до фагоцитозу і невидимим для імунної системи [9,14,15]. Однак, як і інші хімічні методи крослінкінгу, ГА, за деякими даними, призводить до утворення шкідливих цитотоксичних залишків і збільшує викид прозапальних цитокінів макрофагами [16-19]. Останнім часом для крослінкінгу таких полімерів, як колаген, замість хімічних крослінкерів стали використовувати різні методи крослінкінгу, такі як гамма-випромінювання та ультрафіолет [13,20,21].
На відміну від стерилізації етиленоксидом або ГА, гамма-випромінювання не залишає шкідливих залишків, що могли б завдати шкоди здоров'ю людини або навколишньому середовищу, і використовується для стерилізації медичних виробів [6,22]. Більше того, крослінкінг полімерів під дією гамма-випромінювання дає змогу контролювати реакції деструкції, спричинені випромінюванням, наприклад, розщеплення полімерного ланцюга, яке може призвести до зменшення молекулярної маси, оскільки його вплив не залежить від складу матеріалу [23-25]. До того ж під час опромінення колагену гамма-променями пептидні зв'язки руйнуються через деформацію амінокислот, а гідрофільність підвищується завдяки утворенню водневих зв'язків [26]. Крім того, повідомляється, що підвищення гідрофільності поверхні імплантатів, оброблених піскоструминним апаратом із великою зернистістю і кислотним протравленням (SLA), в експериментах із клітинними культурами збільшує рівень лужної фосфатази (ЛФ) більш ніж у 2 рази [27].
На підставі даних абсорбції в попередньому порівняльному дослідженні було зроблено висновок про відсутність різниці між цитотоксичністю групи, підданої крослінкінгу гамма-опроміненням, і групи, підданої ГА-крослінкінгу. Однак, гамма-крослінкінг титанових імплантатів із колагеновим покриттям мав значно вищі показники BIC порівняно з контрольною групою без покриття при дослідженні на прикладі дрібних тварин [28]. Тому ми порівняли ефекти ГА та гамма-крослінкінкінгу колагену I типу на поверхні титанових імплантатів SLA на прикладі з собакою породи бігль, щоб визначити ефективність гамма-крослінкінгу. Нульова гіпотеза полягала в тому, що регенерація кістки і остеоінтеграція після ГА або гамма-крослінкінгу колагену I типу, що покриває імплантати SLA, однакові.
2.1. Експериментальні матеріали
Розчин колагену I типу (0,5% (w/v)) був отриманий шляхом розчинення колагену (джерело: шкіра свині, ателоколаген I типу, Matrixen-PSP, Sk Bioland Co. Ltd., Cheonan, Korea) у 0,05 М оцтової кислоти (Sigma-Aldrich, St. Louis, MO, USA) за кімнатної температури. Титанові імплантати (D 4,0 мм × H 8,0 мм, поверхня SLA, Cowellmedi Co., Ltd., Pusan, Korea) помістили в розчин колагену I типу 0,5% (w/v). Бульбашки на поверхні імплантатів були видалені за допомогою ультразвукової обробки (Elmasonic, S 180 H, Elma Schmidbauer, Elma, Німеччина) протягом 10 хвилин. Далі імплантати були поміщені в кліматичні камери (MIR-253, SANYO, Moriguchi, Японія) для сушіння впродовж 1 години за температури 4 °C.
Імплантати в групі ГА були піддані крослінкінгу шляхом поміщення їх у 2,5% (v/v) ГА (DAEMYUNG CHEMICAL, Gyeonggi-do, Корея) на 1 год.
ГА і колаген I типу, що не вступив у реакцію, видаляли промиванням у дистильованій воді, сушили у вакуумній печі (WOV-30, DAIHAN Scientific Co.Ltd., Канвон-до, Корея) протягом 3 днів [28] і стерилізували етиленоксидом (Виробник, Місто, Штат, Країна). Імплантати групи ГП (гамма-випромінювання) були занурені в розчин колагену таким самим чином, як і в групі ГА, з подальшим ультразвуковим очищенням протягом 10 хв і висушені в кліматичній камері протягом 1 год. Потім імплантати групи ГП були опромінені гамма-променями 60Co (MDS Nordion, Ottawa, ON, Canada) за 25 кГр протягом 1 год [28].
2.2.1 Аналіз шляхом електронної скануючої мікроскопії (СЕМ)
Зображення поверхні імплантатів було отримано за допомогою приладу СЕМ (Hitachi S3500N, Hitachi, Токіо, Японія) в умовах збільшення ×40, ×5000 і ×50 000.
Для СЕМ-дослідження імплантати були покриті золотом (SCD 005, BAL-TEC, Balzers, Ліхтенштейн).
СЕМ-зображення були одержані під напругою 15 кВ.
Поверхні імплантатів аналізували методом XPS (AXIS SUPRA, Kratos Analytical Ltd., Манчестер, Велика Британія) з використанням монохроматичного джерела рентгенівського випромінювання Al-Kα (1486,6 еВ) при напрузі 15 кВ і потужності 225 Вт. Шкалу зв'язку енергії відкалібрували за рівнем C 1s (284,5 еВ). Імплантати кожної групи були піддані композиційному дослідженню за прохідної енергії 160 еВ, а спектри рівнів ядра були отримані за прохідної енергії 20 еВ. Аналіз даних проводили за допомогою програмного забезпечення для редукції даних (Vision 1.5, Kratos Analytical Ltd., Манчестер, Великобританія). Спектри після деконволюції були підібрані з використанням функції суми Гауса і Лоренца (20% Гауса і 80% Лоренца) за допомогою програми XPSPEAK Version 4.1 (Dr. Raymond Kwok, Гонконг, Китай).
2.3.1. Піддослідні тварини
Це дослідження було схвалено Комітетом з етики експериментів на тваринах Національного університету Чоннам (CNU IACUC-YB-2018-94). У дослідженні було використано шість собак породи бігль (самці, три роки, 12 кг).
Перед процедурою собак породи бігль знеболювали томідином (Tomidin®, Provet, Istanbul, Turkey) 10 мкг/кг і тилетамін-золазепамом (Zoletil 50®, Virbac Laboratories, Carros, France) у дозі 5 мг із подальшою інгаляційною анестезією ізофлураном (Sevoflurane®, Hana Pharm Co., Seoul, Korea). Для підтримки анестезії використовували трамадол (Maritrol®, Cheil Pharmaceutical, Uiwang, Корея) 2 мг/кг і карпрофен (Rimadyl® inj, Zoetis, Parsippany, NJ, США) 2,2 мг/кг внутрішньовенно. Крім того, інфільтраційну анестезію в місцях хірургічних втручань проводили з використанням 0,4 мл бупівакаїну (Bupivacaine HCl 0,5% Inj., Myungmoon Pharm Co., Сеул, Корея). Для профілактики інфекції підшкірно вводили 20 мг/кг цефазоліну натрію (Cefazolin®, Chongkundang Pharm Co., Сеул, Корея).
Премоляри (P1-P4) і моляр M1 були видалені після проведення повної санації порожнини рота. Після 8 тижнів відновлення місць видалення зубів було встановлено імплантати [28,29]. Загальна анестезію і місцева інфільтраційна анестезія була проведена згідно з інструкціями для видалення зубів.
У ділянці кожного премоляра був зроблений серединно-крижовий розріз, а в ділянці слизово-ясенного з'єднання - вертикальні розрізи. Після підняття мукоперіостального клаптя гребенева кістка гомогенізувалася шляхом остеопластики з використанням кісткового напилка і кісткових щипців. Букальні кубовидні дефекти заввишки близько 5 мм від гребеневої кістки, глибиною 5 мм від поверхні букальної кістки та завширшки 8 мм у мезіодистальному напрямі створювали за допомогою твердосплавного бору з прямою фісурою під зрошенням фізіологічним розчином (JW Pharmaceutical Co. Ltd., Gyeonggi-do, Корея) (мал. 1А). Тварини випадковим чином були розподілені за трьома групами:
- Група SLA (n = 12): Імплантати SLA без обробки.
- Група ГА (n = 12): Імплантати SLA, з покриттям ГА крослінкінгу колагену I типу GA.
- Група ГП (n = 12): SLA-імплантати,з покриттям крослінкінгу колагену I типу, опроміненим гамма-випромінюванням 25 кГр 60Co.
36 імплантатів (Cowell Medi Co, Ltd., Пусан, Корея) діаметром 4 мм і заввишки 8 мм були імплантовані 6 тваринам у дефекти нижньої щелепи (мал. 1В). Периімплантатні дефекти були заповнені ксенотрансплантатами свинячого походження (BoneXP, MedPark, Пусан, Корея) (мал. 1С), а регенерацію кісткової тканини забезпечувалась колагеновою мембраною, що розсмоктується (Bone-D, MedPark, Пусан, Корея) (мал. 1D). Хірургічні ділянки були зшиті за допомогою 4-0 вікрилу (Mersilk, Ethicon Co., Livingston, UK). Післяопераційний догляд складався з перорального прийому амоксициліну-клавуланату (Amocla®, Kuhnil Pharm Co., Сеул, Корея) 12,5 мг/кг, фірококсибу (Previcox, Merial, Франція) 5 мг/кг та фамотидину (Famotidine®, Nelson, Сеул, Корея) у дозі 0,5 мг/кг протягом 2 тижнів.
Через вісім тижнів після встановлення імплантатів, під наркозом була проведена евтаназія тварин шляхом внутрішньовенного введення хлориду калію (JW Pharmaceutical Co. Ltd., Gyeonggi-do, Корея) .
Нижньощелепні кістки були зібрані.
Протягом 2 тижнів кістки були зафіксовані в нейтральному забуференному формаліні (Duksan Pure Chemical. Co. Ltd., Gyeonggi-do, Корея) .
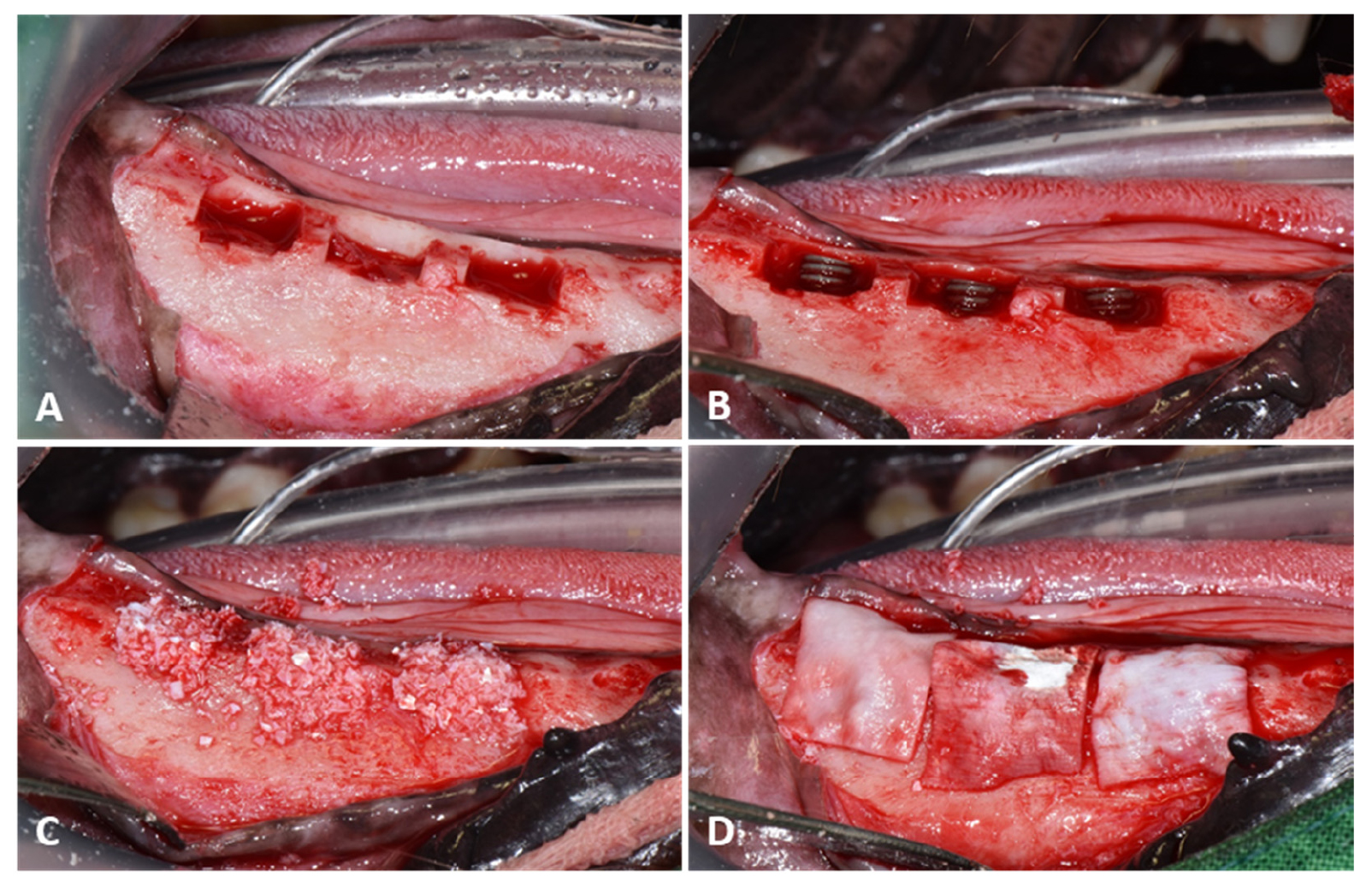
Малюнок 1. Хірургічні процедури, виконані для встановлення оброблених імплантатів у нижню щелепу собаки породи бігль. (A) Створення букальних кубовидних дефектів, (B) Встановлення імплантатів, (C) Нанесення кісткового трансплантата, (D) Встановлення колагенової мембрани.
Нижні щелепи були обгорнуті плівкою Parafilm M® (Heathrow Scientific, Vernon Hills, IL, США) і проскановані за допомогою мікротомографа (Skyscan-1173, версія 1.6, Bruker-CT Co., Контич, Бельгія) при напрузі 130 кВ і інтенсивності 6 для одержання мікротомографічних зображень областей інтересу (ROIs). Використовувалася роздільна здатність пікселів 24,15 мкм для визначення обсягів нової кістки (NBV) в зонах дефектів навколо імплантатів. Реконструкцію мікротомографічних зображень проводили за допомогою програми реконструкції Nrecon версії 1.7.0.4 (Bruker-CT Co., Контіч, Бельгія). У дослідженні використовувалися області інтересу діаметром 1 мм навколо імплантатів (мал. 2).
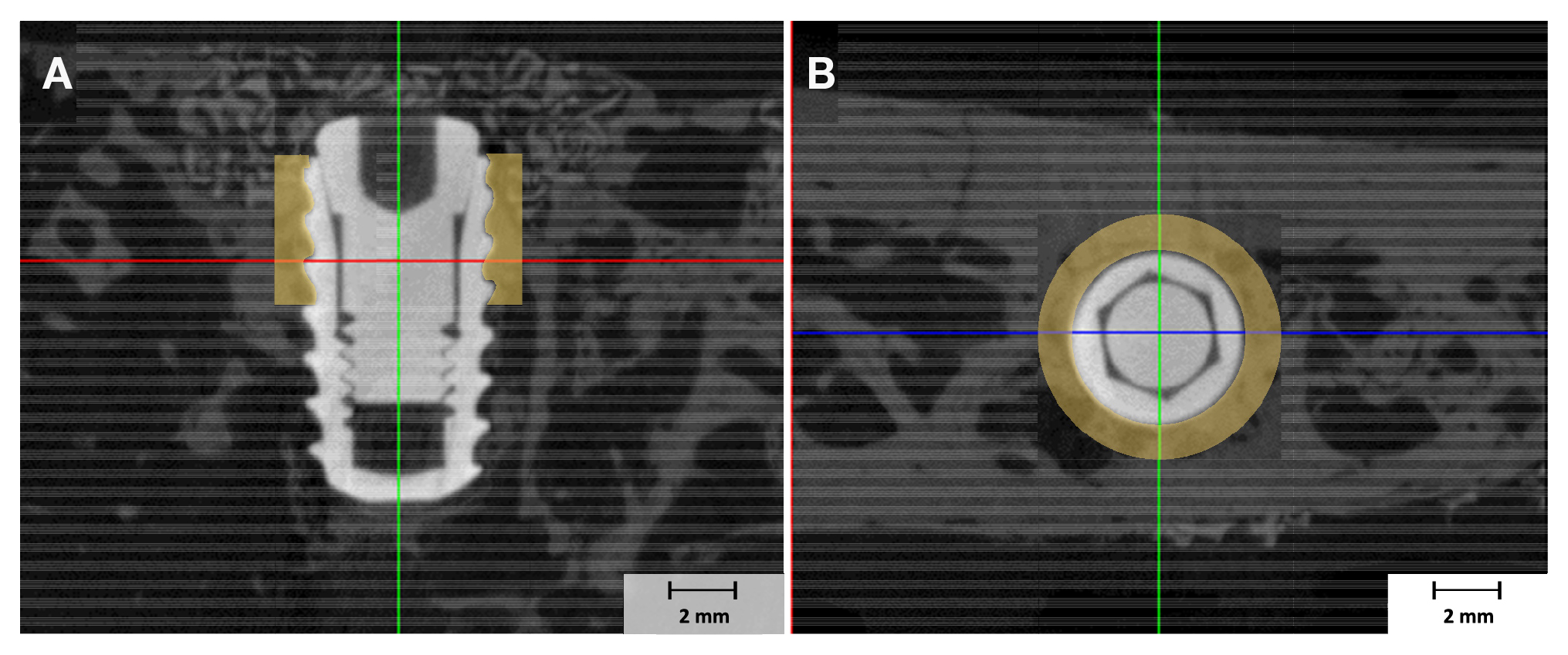
Малюнок 2. Мікротомографічні зображення областей інтерфейсу (ROI): 1 мм навколо кожного імплантату; (А) буккальна проекція, (В) оклюзійна проекція
Після проведення мікротомографії зразки кісткової тканини нижньої щелепи зневоднювали в етанолі (Duksan Pure Chemical. Co. Ltd, Gyeonggi-do, Корея) 70, 80, 90 та 100%, впродовж тижня просочували смолою (Technovit 7200, Heraeus KULZER, Ханау, Німеччина), фіксували на каркасі та закріплювали за допомогою системи УФ-полімеризації (KULZER EXAKT 520, Heraeus Kulzer, Нордерштедт, Німеччина). Полімеризовані зразки розрізали на 400 мкм у центрах імплантатів за допомогою алмазної фрези (KULZER EXAKT 300 CP Band System, Exakt Apparatebau, Нордерштедт, Німеччина). За допомогою шліфувального верстата EXAKT (KULZER EXAKT 400CS, Exakt Apparatebau, Нордерштедт, Німеччина) зразки були відполіровані до товщини 30 мкм. Потім зразки фіксувались на предметних скельцях та забарвлювалися гематоксиліном і еозином (H&E). Зображення забарвлених зразків були отримані за допомогою світлового мікроскопа (Olympus BX, Olympus, Токіо, Японія). Значення BIC і ITBD, а також площі нової кістки (NBA) були виміряні дослідником за допомогою програми аналізу зображень (версія 7.5, i-solution, IMT i-solution. Inc., Ванкувер, Британська Колумбія, Канада) ( мал. 3) навченим дослідником. Точки областей інтерфейсу ROI були встановлені на трьох верхніх різьбах і на 1 мм навколо імплантатів, як показано на мал. 2.
NBAs (%) = Площа нової кістки (мм2)/Загальна площа ROI (мм2) × 100 (1)
BIC (%) = Довжина нової кістки до контакту з імплантатом (мм2)/Загальна довжина ROI імплантату (мм2) × 100 (2)
ITBDs (%) = Площа нової кістки між різьбами (мм2)/Загальна площа між різьбами (мм2) × 100 (3)
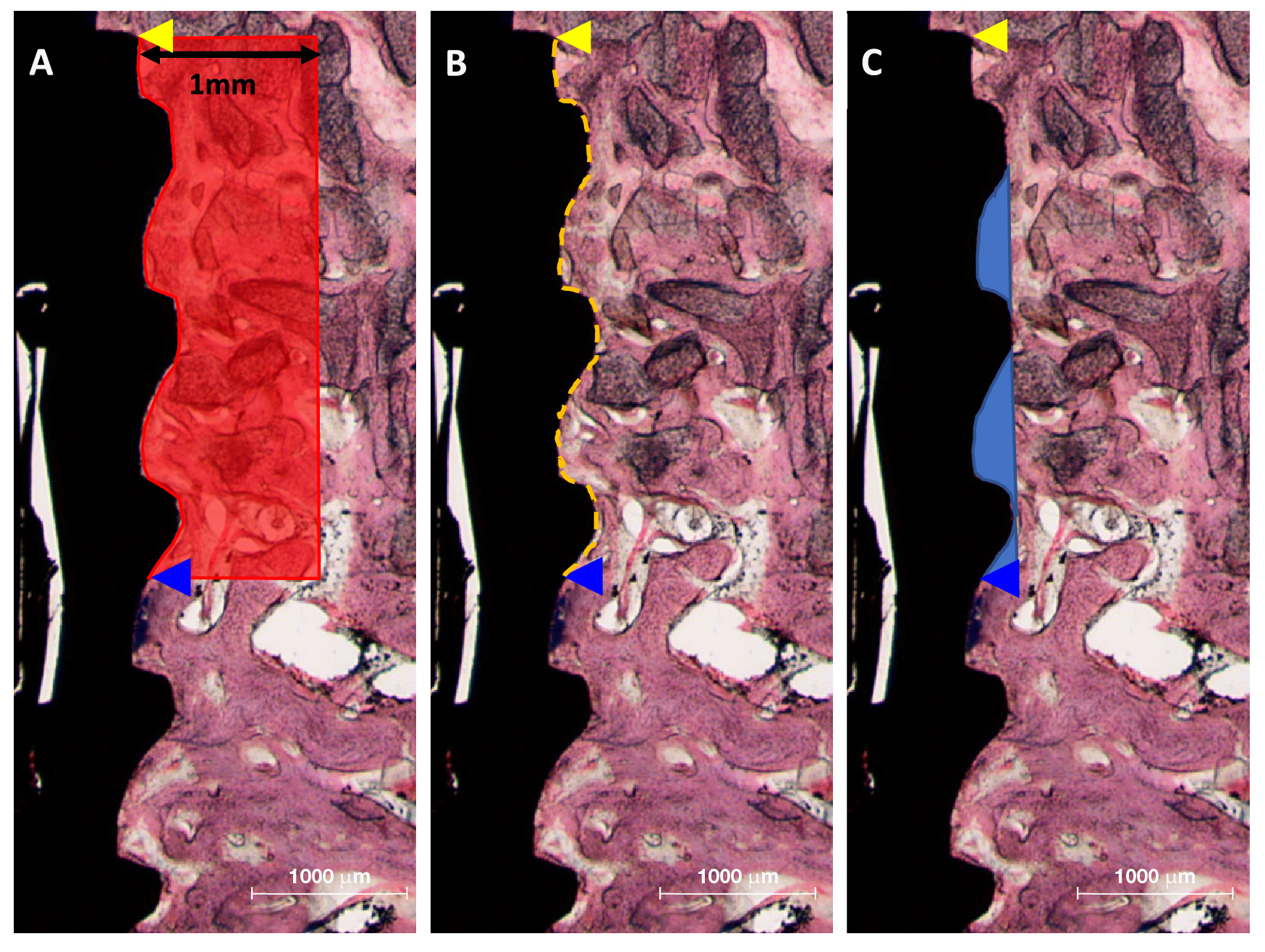
Мал. 3. Гістометричні вимірювання в областях інтерфейсу (ROI). ROI фіксували від платформ імплантатів до третьої різьби та на відстані 1 мм навколо імплантатів в оклюзійній проекції. (А) NBA: Нова площа кістки, (B) BIC: контакт кістки з імплантатом, (C) ITBD: міжрізьбова щільність кісткової тканини.
Результати представлені у вигляді середніх значень ± стандартні відхилення (SD); аналіз проводився за допомогою SPSS версії 25 (SPSS Inc., Чикаго, Іллінойс, США). Оскільки значення NBA, ITBD, NBV та BIC не мали нормального розподілу за тестом на нормальність, для визначення значущості міжгрупових відмінностей використовували односторонній аналіз Крускала-Уолліса. U-критерій Манна-Уїтні застосовувався як постфактум тест. Статистична значущість була прийнята для значень p менше 0,05.
3.1 Дослідження in-vitro
3.1.1 Морфологія поверхні титанових імплантатів, з крослінкінгом колагену
У випадку крослінкінгу колагену за допомогою ГА або гамма-випромінювання 25 кГр на поверхні імплантатів SLA морфологія поверхні була схожою через шорстку поверхню SLA (мал. 4).

Малюнок 4. Зображення скануючої електронної мікроскопії (СЕМ). (A) Група SLA (піскоструминна, крупнозерниста, кислотно-травлена поверхня імплантату), (B) група ГА (глутаральдегід) і (C) група ГП (гамма-випромінювання). [Оригінальні збільшення: ×40,×5000 та ×50 000].
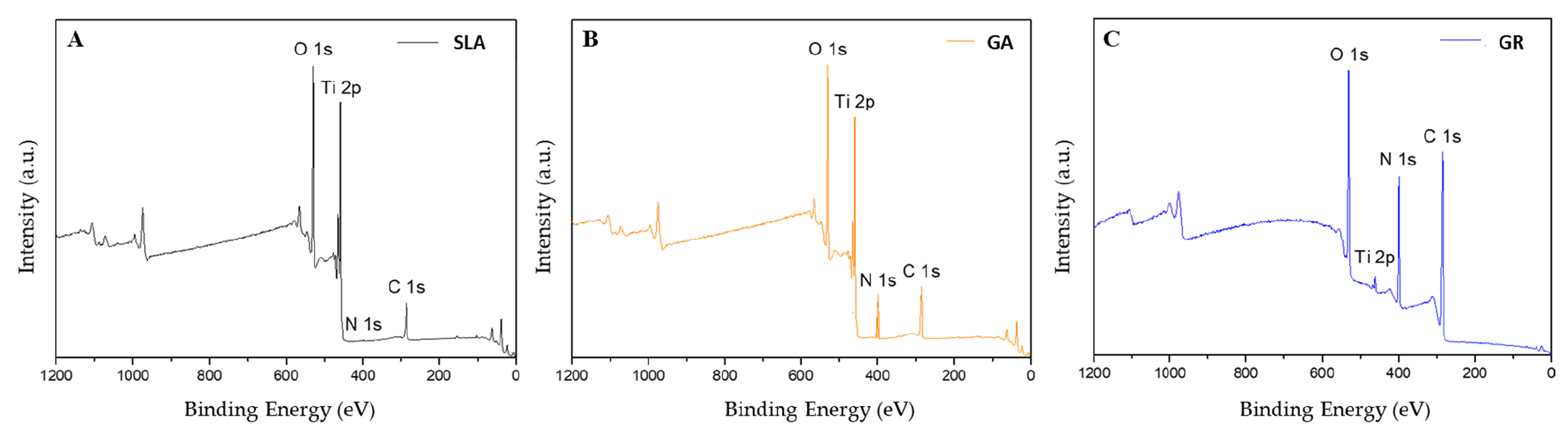
Елементний склад поверхні був визначений методом XPS (Рис. 5).
Група SLA мала найнижчий вміст азоту (0,33%), наступною була група ГА (6,22%) і група ГП (17,64%). Оскільки основним компонентом колагену є желатин (білок), велика кількість азоту свідчить про хороший крослінкінг [30] (Таблиця 1).
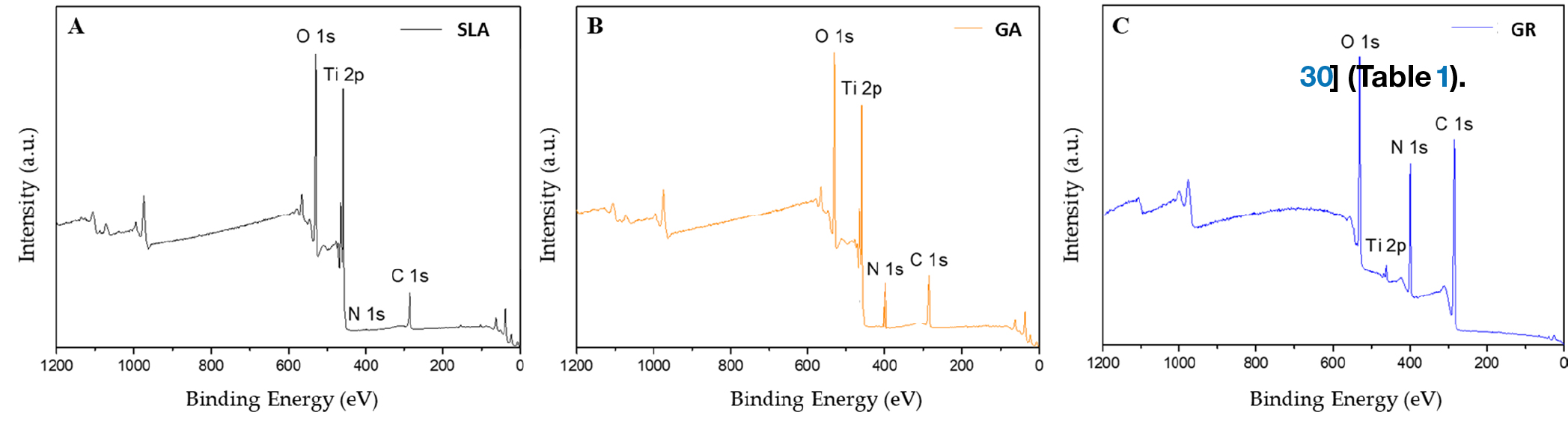
Малюнок 5. Спектри XPS поверхні трьох досліджуваних груп. (A) Група SLA, (B) група ГА і (C) група ГП
Таблиця 1. Концентрація атомів (ат. %) на поверхні імплантатів за даними XP.
Елементи SLA/ГА/ГП
3.2.1 Клінічні результати
Усі собаки породи бігль перенесли хірургічні операції без ускладнень, таких як запалення або інфекція. Сегменти нижньої щелепи були зібрані після евтаназії собак.
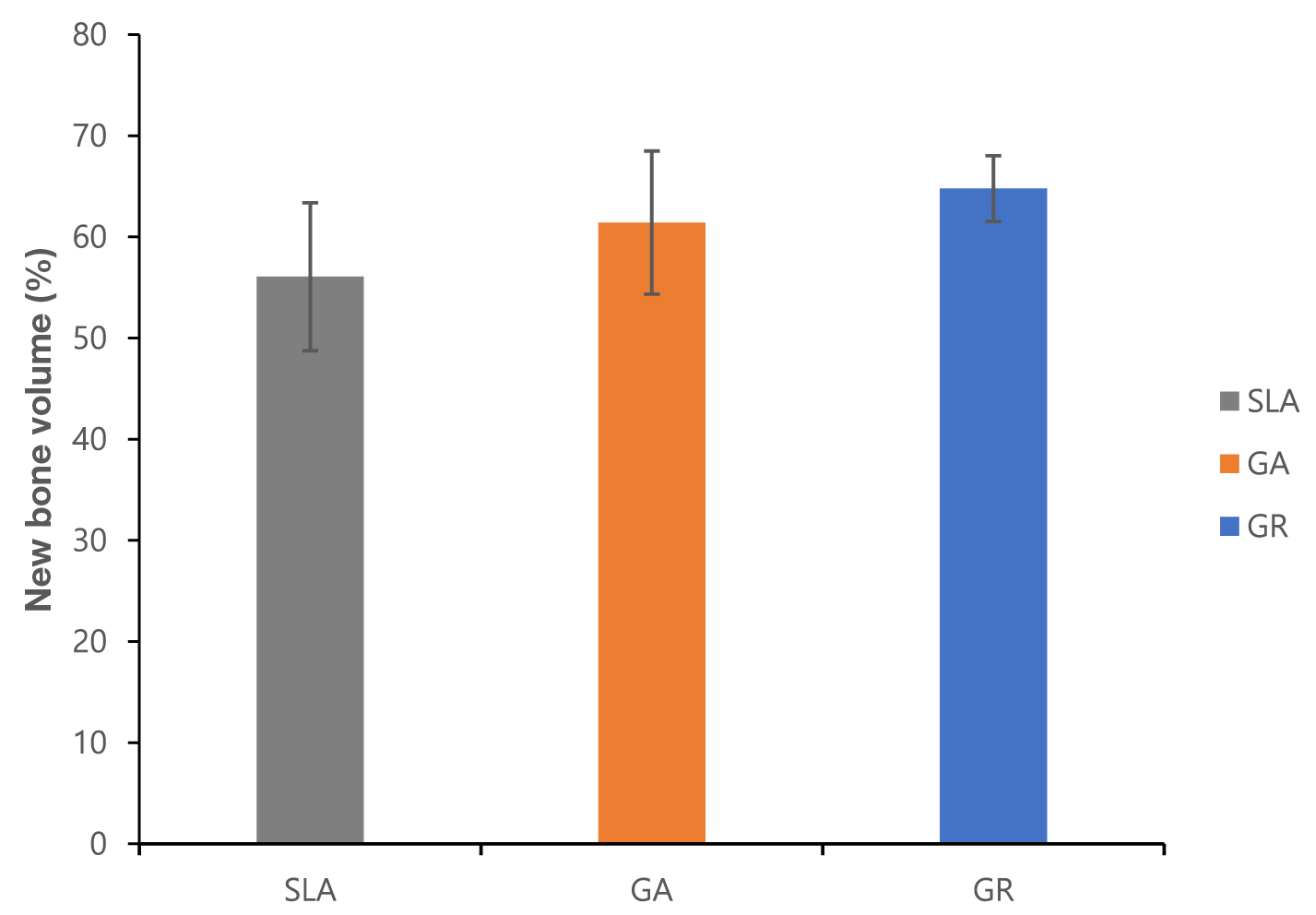
В областях, що становлять інтерфейс, об'єм нової кістки становив: 64,78 ± 3,24% у групі ГП, 61,42 ± 7,07% у групі ГА, і 56,06 ± 7,31% у групі SLA. Незважаючи на те, що об'єм нової кістки у групі ГП був відносно високим, відмінності були незначними (рис. 6).

Елементи SLA/ГА/ГП
Малюнок 6. Об'ємний аналіз областей інтерфейсу, об'єм нової кістки
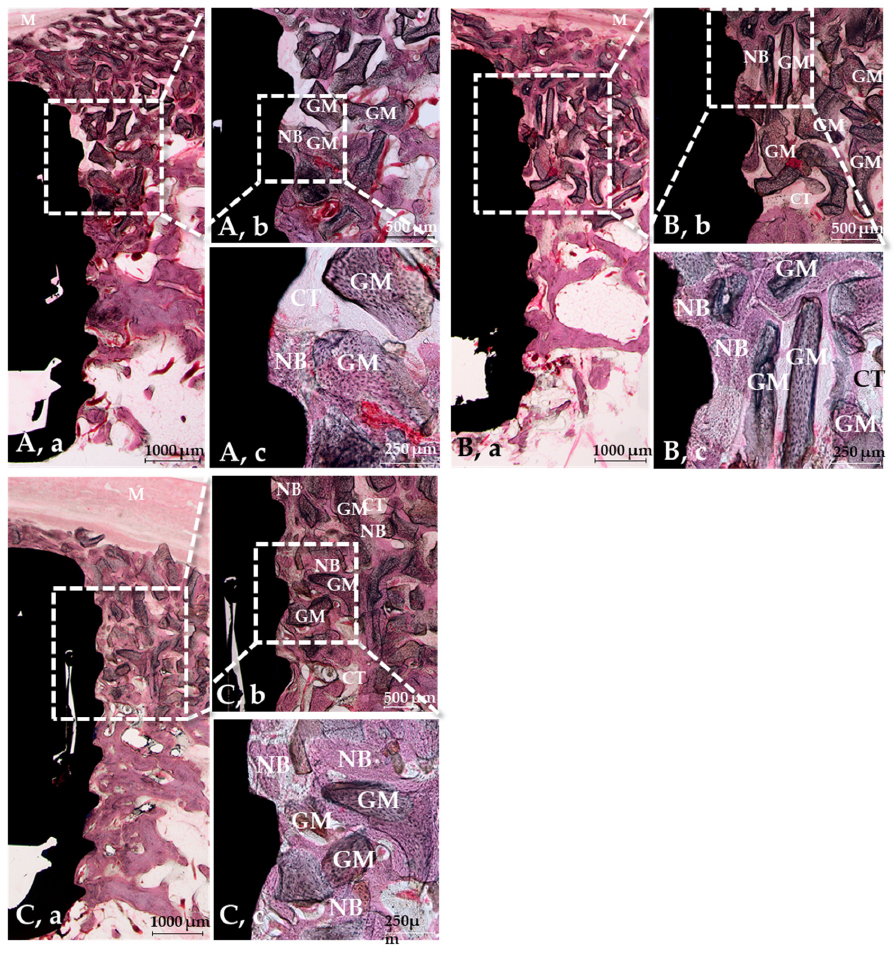
Результати гістологічного дослідження в групах SLA, ГА і ГП представлено на малюнку 7.
У жодній із груп не було виявлено аномальних запальних клітин або одиничних утворень.
Утворення нової кістки між третьою і другою різьбою спостерігалося в групі SLA. Утворення нової кістки у всіх групах GA і GR розподілялося рівномірно.
У групі крослінкінгу спостерігалося більше утворення нової кістки, ніж у групі SLA, але в групах ГА і ГП утворення нової кістки було однаковим.
Малюнок 7. Забарвлені гематоксиліном і еозином розрізи на 8 тижні після імплантації.
(A) Група SLA, (B) група ГА, (C) група ГП, (a) ×12,5, (b) ×40, (c) ×100.
Примітка: NB = нова кістка, GM = матеріал кісткового трансплантата, CT = сполучна тканина, M = мембрана.
Результати гістометрії представлені в таблиці 2 і на малюнку 8. Значення об'єму нової кістки в групах SLA, ГА і ГП становили 38,27 ± 9,34%, 52,37 ± 7,93% і 43,77 ± 8,81% відповідно і були значно вищими в групі ГП, ніж у групі SLA (p < 0,05). Таблиця 2. Середні значення площі нової кістки (NBA), щільності кістки в області різьби (ITBD) і контактів між кісткою та імплантатом (BIC), визначені за допомогою гістометричного аналізу. (Значення/ Група/ Середнє значення ± стандартне відхилення/ Значення p )
* Вказує на статистичну значущість (p менше 0,05)
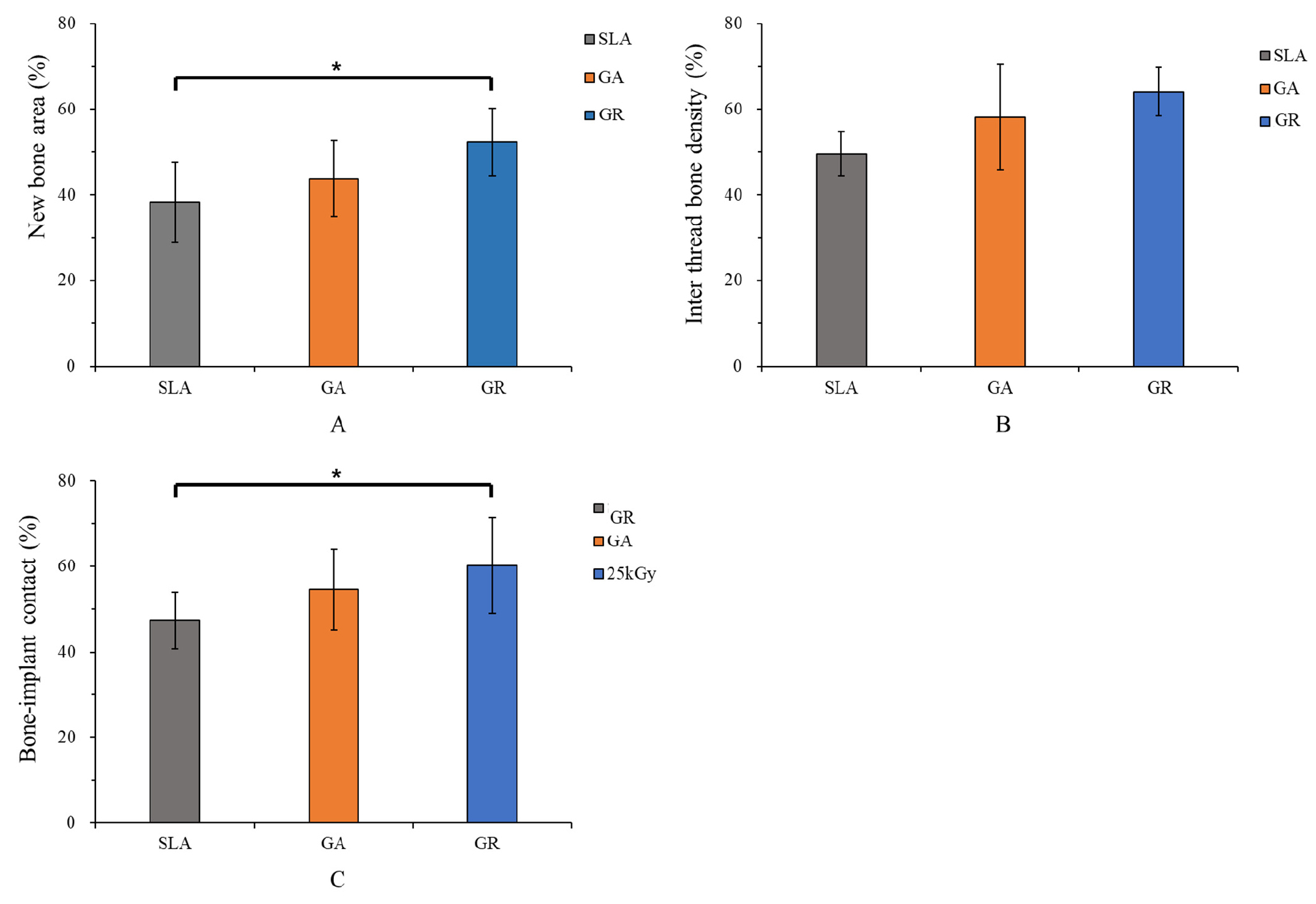
Малюнок 8. Гістометричний аналіз в областях інтерфейсу (ROI). (A) Площа нової кістки (%), (B) Щільність кістки в області різьби (%), (C) Контакт кістка-імплантат (%). * Вказує на статистичну значущість (p < 0,05).
Результати ITBD у групах SLA, ГА і ГП становили 49,52 ± 5,11 %, 58,10 ± 12,33 % і 64,10 ± 5,65 % відповідно, і значних відмінностей між групами не було виявлено (p > 0,05).
Відповідні результати BIC становили 47,3 ± 6,58 %, 54,61 ± 9,4 % і 60,19 ± 11,23 %, причому BIC був значно вищим у групі ГП, ніж у групі SLA (p < 0,05). З іншого боку, результати групи ГП були схожі зі значеннями групи ГА за показниками NBA, ITBD і BIC (p > 0,05).
Прийнято вважати, що комерційно доступні дентальні імплантати мають високу біосумісність і поверхню, придатну для регенерації кістки [4,31], що підтверджуються результатами проспективних і ретроспективних клінічних досліджень, у яких 10-річне виживання імплантатів перевищувало 90 % [32-35]. Проте відторгнення дентальних імплантатів через порушення остеоінтеграції часто відбувається несподівано і залишається важливою клінічною проблемою [36,37]. Тому було проведено дослідження методів модифікації поверхні імплантатів з метою поліпшення остеоінтеграції з використанням поверхневого оброблення колагену як біоактивного матеріалу [38,39]. Однак механічні властивості та стабільність екстрагованого колагену невеликі, тому його потенціал обмежений [40,41]. ГА використовується як агент для крослінкінгу колагену вже кілька десятиліть, але частина ГА, ймовірно, залишається на місці після крослінкінгу. Для розв'язання цієї проблеми були запропоновані протоколи видалення непрореагованого ГА, але, на жаль, ці методи також мають цитотоксичні побічні ефекти [42,43]. З іншого боку, крослінкінг на основі гамма-випромінювання не залишає шкідливих слідів і нещодавно був використаний для крослінкінгу полімерів, включаючи колаген [6]. Тому дане дослідження було проведено для оцінки та порівняння переваг крослінкінгу колагену I типу на поверхні SLA-імплантатів за допомогою гамма-випромінювання або ГА на великій тварині.
Колаген I типу є корисним біополімером і широко використовується в клінічній практиці завдяки своїй низькій імуногенності, біосумісності та біомедичному потенціалу [42]. Крім того, відомо, що колаген сприяє адгезії остеобластів при нанесенні на поверхню імплантатів [9]. Попередні дослідження in vivo підтвердили, що обробка колагеном сприяє регенерації кістки після імплантації крослінкованих титанових імплантатів із колагеновим покриттям і що обробка колагеном посилює адгезію кістки до імплантату та прискорює формування кістки [44,45]. У цьому дослідженні значення NBAs і BIC були вищими в групі ГП, ніж у групі SLA, як і в групах ГА і SLA, що свідчить про те, що гамма-опромінення 25 кГр забезпечує кращий рівень крослінкінгу, ніж ГА. Крім того, аналіз XPS показав, що рівень поверхневого азоту (17,64 %) був вищим у групі ГП, ніж у групі ГА (6,22 %).
Однак група ГП істотно не відрізнялася від групи ГА (p > 0,05).
Після механічної обробки титану його поверхня забруднюється адсорбованими органічними речовинами, такими як атмосферні вуглеводні, вода або миючі рідини [46,47]. Попередні дослідження, які аналізували хімічний склад різних поверхонь імплантатів за допомогою XPS, показали, що відсоток відкладення вуглецю коливається від 17,9 до 76,5% [48]. Тому для швидкої дезінфекції та стерилізації медичних виробів було рекомендовано використовувати гамма-опромінення в дозі від 25 до 35 кГр. Уено та ін. [49] виявили, що відкладені вуглеводні можна видалити за допомогою високоенергетичного ультрафіолетового або гамма-випромінювання, і що видалення вуглеводнів покращує біосумісність титану та індукує остеоінтеграцію. Наші результати XPS показали, що поверхневий вміст вуглецю в групах ГП, ГА та SLA становив 0,93, 6,22 та 20,96% відповідно, що свідчить про те, що поверхневий вуглець був видалений за допомогою гамма-променів [30]. Це зменшення рівня поверхневого вуглецю під впливом гамма-опромінення відповідає результатам попередніх досліджень [6].
Таким чином, це дослідження дає змогу припустити, що крослінкінг колагену під дією гамма-опромінення покращує біосумісність титанових імплантатів та адгезію до кістки в моделі нижньої щелепи собаки породи бігля. Крослінкінг колагену імплантатів за допомогою гамма-опромінення може поліпшити остеоінтеграцію за несприятливих обставин, які потребують проведення процедури трансректального синус-ліфтингу [50]. Крім того, у пацієнтів із системними захворюваннями в анамнезі підвищення ступеня остеоінтеграції імплантату з кісткою може бути важливим фактором для довгострокового виживання імплантату [51]. Тим часом Misch [52] рекомендував робити оклюзійну ділянку імплантата невеликою. Оскільки підвищена остеоінтеграція збільшує механічну міцність кісткової тканини, оклюзія протеза на імплантаті може бути правильно розподілена [53].
Крім того, якщо речовину, що викликає реакцію стовбурових клітин, наприклад rhBMP-2, прикріпити до колаген-крослінкінгового імплантату за допомогою гамма-випромінювання, можна очікувати кращої остеоіндукції. Однак дослідження було обмежене використовуваною кількістю собак породи бігль, які брали в ньому участь, і його короткою тривалістю. Крім того, не було виявлено відмінностей у гістологічному аспекті порівняно з групою ГА. Крім того, видається необхідним порівняти його з іншими біосумісними матеріалами, крім колагену. Відповідно, ми рекомендуємо провести додаткові експерименти, щоб створити наукове підґрунтя для клінічної ефективності крослінкінгу колагену на титанових імплантатах за допомогою гамма-випромінювання.
Дане дослідження було проведене для оцінки впливу гамма-випромінювання, викликаного крослінкінгом колагену, на остеоінтеграцію і регенерацію кістки в зонах дефектів навколо імплантатів SLA. В рамках даного дослідження було встановлено, що крослінкінг колагену під дією гамма-випромінювання є не менш ефективним, ніж гамма-крослінкінг, з точки зору ефективності регенерації кістки.
Згідно з нашими результатами, гамма-випромінювання може бути використане для ефективного крослінкінгу колагену на поверхні імплантатів і не викликати побоювань з приводу токсичних слідів. Необхідні додаткові дослідження на тваринах для визначення критеріїв оптимальної дози гамма-опромінення і більш повної оцінки впливу опромінення на остеоінтеграцію.
Внесок авторів: Концептуалізація, J.-B.H.; методологія, J.-B.H., C.-M.J., S.-E.K. і S.-S.K.; формальний аналіз, W.-T.C. і S.-H.H.; дослідження, W.-T.C. і S.-H.H.; обробка даних, W.-T.C., S.-H.H., S.-I.J. і S.-. Y.K.; написання оригінального проекту, J.-B.H., S.-Y.K. та W.-T.C.; написання рецензії та редагування, C.-M.J., W.-T.C. та J.-B.H.; контроль, J.-B.H. Всі автори прочитали та погодилися з опублікованою версією рукопису.
Фінансування: Робота виконана за підтримки Національного дослідницького фонду Кореї (NRF), що фінансується урядом Кореї (MSIT) (грант № NRF-2020R1A2C1004927).
Заява Ради з інституційного нагляду: Дослідження було схвалено Інституційним комітетом з догляду та використання тварин (IACUC) Чоннамського національного університету (CNU IACUC-YB-2018-94, 07-01-2019).
Заява про інформовану згоду: Не застосовується.
Заява про доступність даних: Спільне використання даних не застосовується.
Конфлікти інтересів: У авторів немає конфлікту інтересів, про який вони могли б заявити.


